医科院药物所戴均贵、陈大伟团队与中国科学院微生物所刘宏伟团队JACS:利用糖基转移酶为探针定向挖掘真菌源活性糖苷分子
近日,中国医学科学院药物研究所戴均贵、陈大伟团队与中国科学院微生物研究所刘宏伟团队在Journal of the American Chemical Society 发表了研究论文,利用糖基转移酶导向的基因组挖掘策略,从真菌中高效定向发现多个结构新颖、药理活性广泛的糖苷化合物,为真菌中结构新颖活性天然产物的定向发现提供了新思路与新策略。
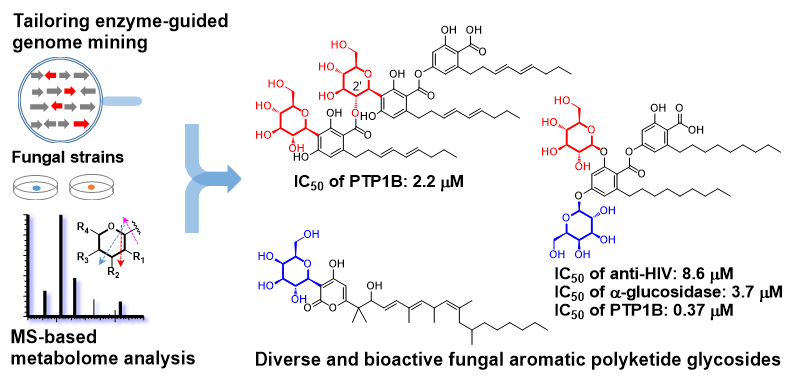
糖苷化合物是活性天然产物及临床药物的重要组成部分,其分子中的糖基基团不仅是重要的药效基团,还可改善化合物的药代动力学特性,增加成药性。天然糖苷化合物大多数来源于植物和细菌,真菌中发现的糖苷极少。目前,依靠传统发酵、提取分离方法从真菌中仅发现400多个糖苷化合物。自然界中至少存在200万种真菌,蕴含着巨大的糖苷类化合物生物合成潜力,但仅依靠传统的分离纯化手段严重限制了新颖活性糖苷化合物的高效发现与分子创新。因此,如何从数量庞大的真菌中高效、定向挖掘新颖结构活性糖苷并进行分子创新是目前该领域研究的难点。
医科院药物所戴均贵研究员团队一直致力于复杂活性糖苷化合物的生物合成、分子创新及药物发现的研究。近年来,从药用植物和真菌中发现多个新颖、杂泛性糖基转移酶,并作为工具酶用于合成多种复杂活性糖苷分子,相关成果已相继发表(Angew. Chem. Int. Ed., 2015, 54, 12678; ACS Catal., 2018, 8, 4917; Nat. Commun., 2020, 11, 5162)。基于前期系列创新性成果,该团队进一步利用糖基转移酶为探针进行基因组挖掘,在真菌源活性糖苷分子的定向发现与分子创新方面取得重要进展。
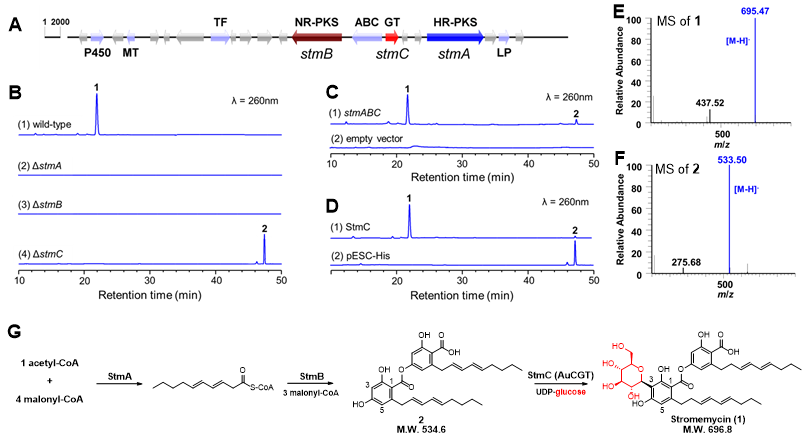
图1. 真菌源C-糖基转移酶AuCGT的功能鉴定
在该工作中,医科院药物所戴均贵、陈大伟团队与中国科学院微生物所刘宏伟团队合作,首先解析了聚酮C-糖苷stromemycin的生物合成途径,发现真菌中首个C-糖基转移酶AuCGT(图1)。以C-糖基转移酶AuCGT为探针,通过同源蛋白挖掘、生物信息学分析,从NCBI等数据库中挖掘到158个AuCGT同源蛋白及80个候选菌株。进化树分析显示,AuCGT及其同源蛋白处于独立的进化分支,与已报道真菌O-糖基转移酶和细菌C-糖基转移酶相似度较低,亲缘关系较远(图2),这为理解细菌源、真菌源、植物源C-糖基转移酶之间的遗传进化关系以及阐明C-糖基转移酶的催化机制提供更多信息。虽然从上述绝大多数候选真菌中并未分离得到糖苷化合物,但通过antiSMASH分析预测,大部分AuCGT同源蛋白与聚酮合酶pks成簇分布,提示其合成聚酮糖苷化合物的潜力。
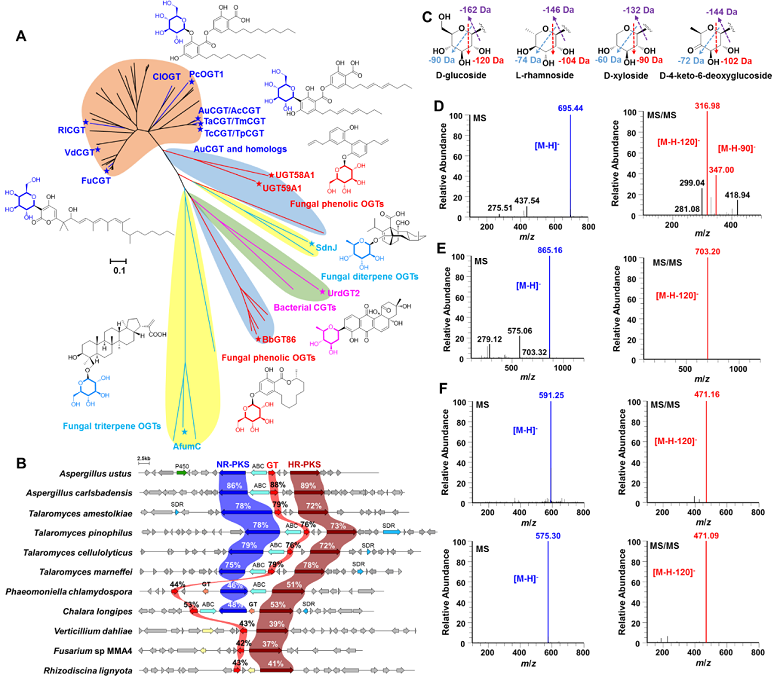
图2. AuCGT导向的基因组挖掘和真菌源糖苷定向发现
为验证候选菌株的聚酮糖苷合成潜力,作者优选7株真菌进行发酵培养。通过异源表达、更换培养条件、交换启动子等策略激活候选基因簇,并对其代谢产物进行分析,结合糖苷化合物的MS特征裂解规律,确定了它们合成糖苷化合物的能力。进一步基于LC-UV-MS指导定向分离,从3株真菌中分离得到28个糖苷化合物,其中20个为新化合物,包括缩酚酸C-糖苷、缩酚酸O-糖苷和α-吡喃酮C-糖苷等,糖基单元包括葡萄糖、半乳糖和脱氧糖,极大拓展了天然糖苷化合物的结构多样性(图3)。同时还发现一些新颖缩酚酸C-/O-糖基转移酶和α-吡喃酮C-糖基转移酶,进一步确定了其它候选真菌具有合成该类糖苷化合物的能力。这些新颖糖基转移酶可以继续作为“酶探针”用于后续的基因组挖掘,定向发现真菌中更多不同结构类型的新颖糖苷化合物。同时,将这些新颖糖基转移酶作为基因元件用于组合生物合成与分子创新,进一步拓展了糖苷化合物的结构多样性(图4)。

图3. 三株代表性真菌中新颖糖苷化合物

图4. 新颖糖苷化合物的组合生物合成
该研究为真菌中更多结构新颖糖苷甚至其它类型化合物的定向发现与分子创新提供了新思路与新策略,尤其是含量低微或生物合成基因簇沉默的天然产物。同时为抗病毒、抗菌、抗糖尿病等创新药物研发提供了结构类型多样的活性分子。
中国医学科学院药物研究所陈大伟副研究员、宋治军博士和中国科学院微生物研究所韩俊杰副研究员为共同第一作者,中国医学科学院药物研究所陈大伟副研究员、中国科学院微生物研究所刘宏伟研究员和中国医学科学院药物研究所戴均贵研究员为共同通讯作者。该研究得到了国家自然科学基金和医科院创新工程的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Targeted Discovery of Glycosylated Natural Products by Tailoring Enzyme-Guided Genome Mining and MS-Based Metabolome Analysis
Dawei Chen*, Zhijun Song, Junjie Han, Jimei Liu, Hongwei Liu*, and Jungui Dai*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.3c12895
导师介绍
戴均贵
https://www.x-mol.com/university/faculty/27240
刘宏伟
https://www.x-mol.com/university/faculty/148669
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!





























 京公网安备 11010802027423号
京公网安备 11010802027423号