利物浦大学John Bower团队Nat Chem:直接烯醇化策略合成手性β-取代的ɑ-氨基酸
氨基酸可以说是有机合成化学家眼中最有价值的结构单元。传统的合成手性氨基酸的方法主要集中在控制其α-立体中心上,而对于β-立体中心的α-氨基酸的合成则极具挑战。迄今为止,合成该类氨基酸的方法十分有限且需要合成复杂的前体或特殊的反应条件。例如通过生物催化或不对称合成方法合成一些具有β-立体中心的α-氨基酸,但这些方法通常存在一定的局限性,并且不适用于高效地合成β-立体中心的α-氨基酸。此外,关于酸性相对较低的酰胺α-位的直接不对称烷基化(例如无需额外加入当量的碱或无需对底物进行预官能团化)的报道还很少。近日,利物浦大学John F. Bower教授(点击查看介绍)课题组从简单易得的甘氨酸衍生物和苯乙烯出发,成功实现了通过甘氨酸衍生物的N-H官能团作为导向基,在铱催化下经过“软”的烯醇化得到立体几何确定的手性烯醇中间体,进而与铱活化的烯烃发生C-C键偶联得到β-立体中心的α-氨基酸衍生物的反应。相关成果发表于Nature Chemistry。
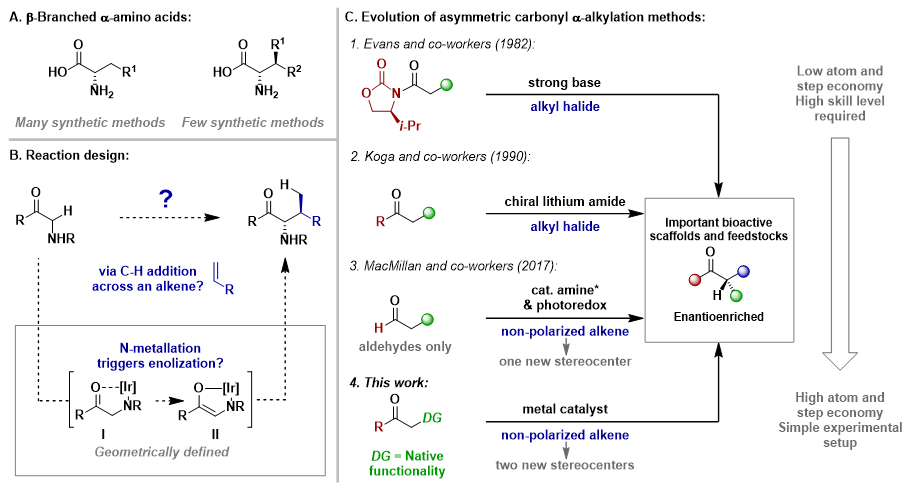
图1. 反应的背景和设计
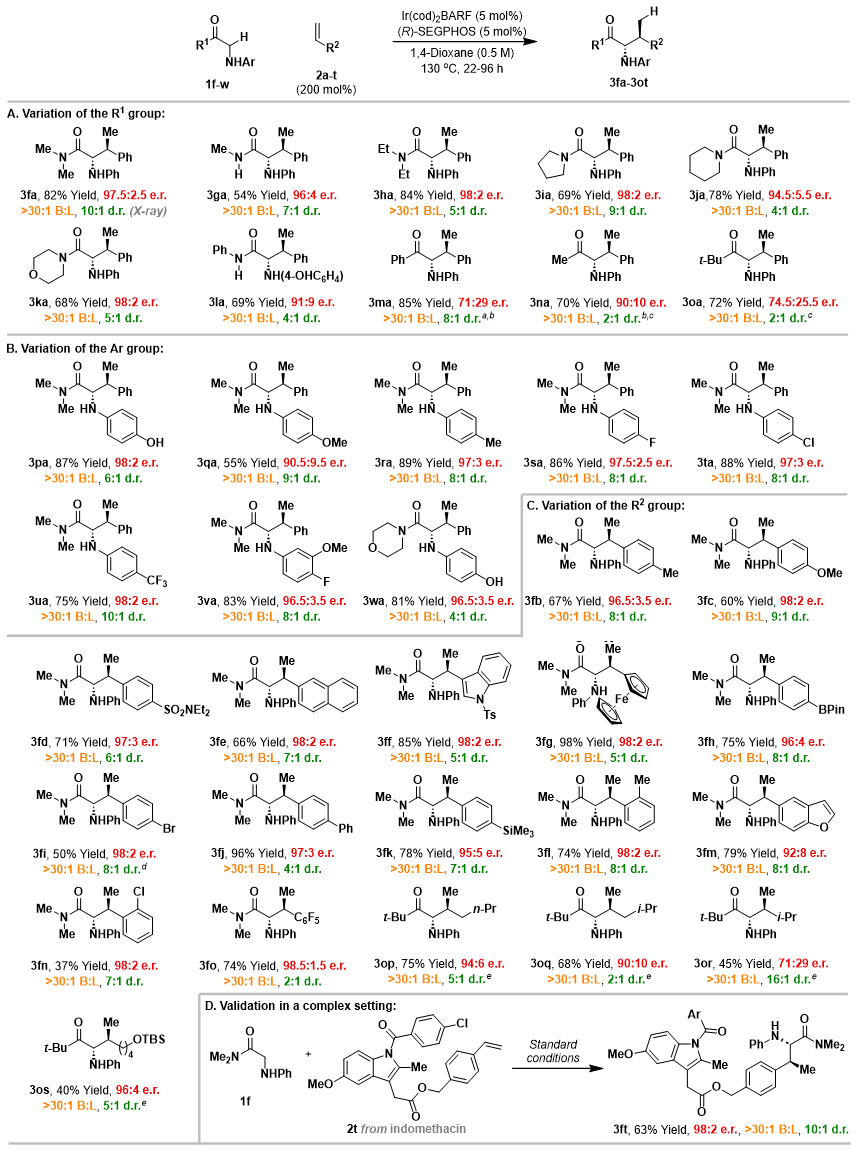
图2. 底物普适性研究
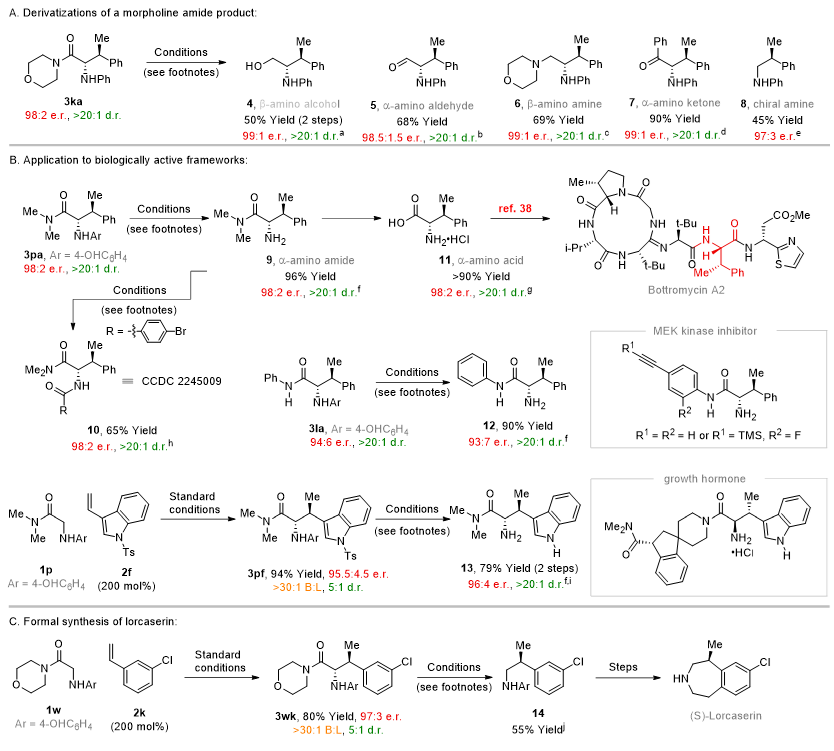
图3. 产物衍生化
为了探究该反应的具体机理,作者进行了一系列机理实验。首先,控制实验说明该C-C键形成过程需要羰基和NHAr部分。此外,在外消旋的模型反应中加入10个当量的D2O,发现回收的底物中C2位置有1.17 D。没有加入Ir催化剂时该位置却没有任何氘原子取代。这两个实验说明Ir催化剂确实促进了甘氨酸底物的烯醇化,从而导致C2位置有一定比例的氘原子。把大于50:1 d.r.的产物置于外消旋的反应条件中,发现可以以97%产率回收该产物,其d.r.保持不变且产物C2位置没有任何氘原子取代。这个实验说明了只要反应生成产物后,其结构是非常稳定的,不会随着反应的进行导致其非对映选择性的改变。13C机理实验观察到烯烃的C1(1.013)和C2(1.008)上都有明显的KIEs效应。该实验说明碳金属化步骤可能是该反应的转换限速步(图4)。

图4. 机理实验
基于上述机理实验,提出了该反应可能的机理(图4)。首先,N-H金属化得到中间体I(该类启动反应在课题组已报道的Rh催化C-C键活化的反应中已经被证实),进而Ir催化剂作为路易斯酸促进底物中羰基的烯醇化得到中间体II。此时,Ir可能有或没有被质子化,这里只列出没有质子化的过程。紧接着,烯烃部分被II活化或另外一个Ir催化剂III活化。为了区分这个过程,进行了动力学实验,发现催化剂Ir的级数是2级。因此,动力学实验支持双金属活化的过程,既含Ir的enolate进攻另外一个Ir活化的烯烃得到双Ir取代的中间体IV。最后,质子去金属化得到产物以及催化剂的再生。值得一提的是该不对称的诱导可能是C-C键形成步骤。此外,支链选择性可能是由于金属Ir的半径相对较大(可能是由于位阻的原因,Ir催化剂选择位阻较小的烯烃末端)和(或)中间体II的电性决定的,导致支链产物是主要的产物。其他的可能机理,例如先发生N-H键对Ir催化剂的氧化加成后脱氢或氧化环化的机理可以被排除。
小结
John F. Bower教授课题组发展了一种Ir催化烯烃的不对称氢烷基化的方法。通过大量机理实验,认为该反应可能是先通过Ir活化甘氨酸衍生物生成具有亲核性的“软”enolate中间体,进而进攻另外一个Ir活化的烯烃,经历了一种较为少见的双金属催化的机理。该反应以单一的化学选择性、区域选择性,很高的对映选择性和非对映选择性获得连续两个手性中心的β-位取代的α-氨基酸,且没有任何副产物的产生(图4)。最后,基于产物进行了大量有用的化学转化,例如合成了β-位立体中心取代的α-氨基酸、完成了多种天然产物的形式合成和合成了多种活性分子的核心骨架。
该研究工作主要由John F. Bower教授课题组博士后研究员洪凤林完成,并得到课题组Timothy P. Aldhous博士的协助和AstraZeneca公司Paul D. Kemmitt博士的帮助。研究工作得到the Bristol Chemical Synthesis Centre for Doctoral Training funded by the EPSRC (EP/M507994/1),AstraZeneca (studentship T. P. A.), the ERC (Grant no. 863799 “ChiCC”)和the University of Liverpool (Regius Chair to J. F. B.) 等基金的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A directed enolization strategy enables by-product-free construction of contiguous stereocentres en route to complex amino acids
Fenglin Hong, Timothy P. Aldhous, Paul D. Kemmitt & John F. Bower
Nat. Chem., 2024, DOI: 10.1038/s41557-024-01473-5
John F. Bower教授课题组简介
课题组的研究方向主要围绕以下三方面展开:(1)Pd催化氮杂Heck反应。该策略由N-O键对低价Pd的氧化启动,进而与不饱和键,例如烯烃或炔烃等,发生插入等串联反应以高效地构筑各种合成上非常有用的杂环化合物,尤其是手性含氮杂环;(2)Rh催化C-C键活化。该策略通过利用环张力引发的氧化插羰,进而与不饱和键,例如烯烃或炔烃等,发生插入的串联反应。该类反应同样被用以快速地构建多种含氮杂环化合物;(3)Ir催化烯烃的不对称氢芳基化反应。课题组通过设计导向基与Ir配位,进而与芳基邻位的C-H键发生氧化加成,最后对未活化烯烃的插入,实现对未活化烯烃的氢芳基化反应。2018年,课题组通过自身发展的手性配体实现该类反应的不对称版本。以上三种策略成功应用于多种天然产物、生物活性分子和药物的高效简洁合成。

课题组从2010年成立以来,已在国际著名刊物Nat. Chem.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Chem. Sci.、ACS Catal.等上发表通讯作者论文70余篇。
John F. Bower教授简介

John F. Bower,利物浦大学化学学院教授,课题组长。1999年至2003年本科就读于布里斯托大学化学系。2003年至2007年博士就读于布里斯托大学化学系(导师:T. Gallagher)。2007年至2010年先后分别在美国德克萨斯大学奥斯汀分校(合作导师:M. J. Krische) 及英国牛津大学(合作导师:T. J. Donohoe)从事博士后研究。2010年受Royal Society University Research Fellow的资助进入布里斯托大学工作。2020年被利物浦大学授予“Regius Chair of Chemistry”称号,2020年至今,在利物浦大学化学学院工作。
https://www.x-mol.com/university/faculty/3211
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






























 京公网安备 11010802027423号
京公网安备 11010802027423号